В днешно време неалкохолната мастна болест на черния дроб (НАХБЧ) се е превърнала в основна причина за хронично чернодробно заболяване в Китай и дори в света. Спектърът на заболяването включва обикновен чернодробен стеатохепатит, неалкохолен стеатохепатит (НАХБ) и свързаните с него цироза и рак на черния дроб. НАХБ се характеризира с прекомерно натрупване на мазнини в хепатоцитите и индуцирано клетъчно увреждане и възпаление, със или без чернодробна фиброза. Тежестта на чернодробната фиброза при пациенти с НАХБ е тясно свързана с лоша чернодробна прогноза (цироза и нейните усложнения и хепатоцелуларен карцином), сърдечно-съдови събития, екстрахепатални злокачествени заболявания и обща смърт. НАХБ може да повлияе неблагоприятно на качеството на живот на пациентите; въпреки това, все още не са одобрени лекарства или терапии за лечение на НАХБ.
Неотдавнашно проучване (ENLIVEN), публикувано в New England Journal of Medicine (NEJM), показа, че пегозафермин подобрява както чернодробната фиброза, така и чернодробното възпаление при пациенти с нециротичен NASH, потвърден чрез биопсия.
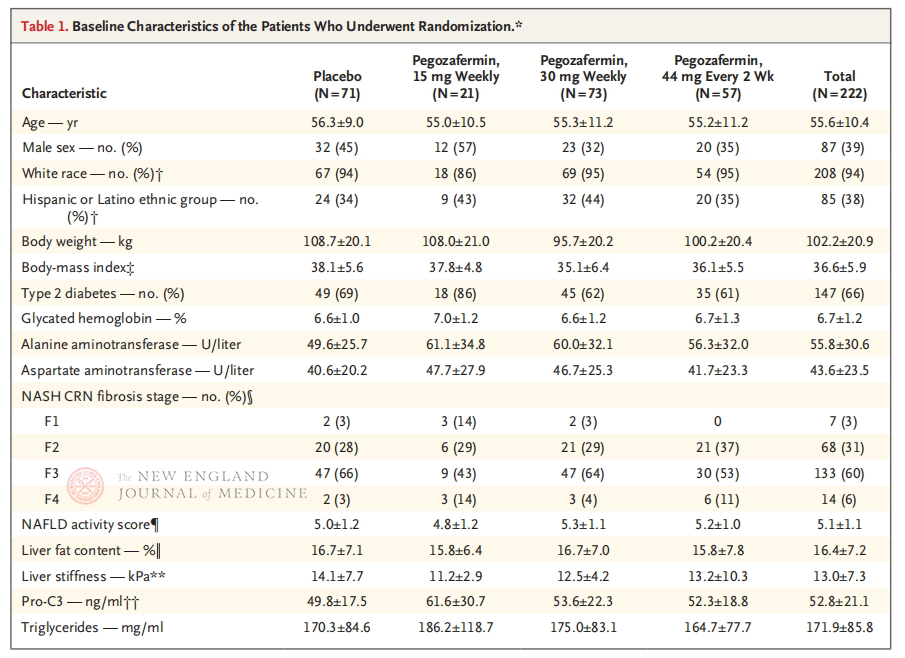
Многоцентровото, рандомизирано, двойносляпо, плацебо-контролирано клинично проучване фаза 2b, проведено от професор Рохит Лумба и неговия клиничен екип в Медицинския факултет на Калифорнийския университет в Сан Диего, включва 222 пациенти с потвърден чрез биопсия NASH стадий F2-3 между 28 септември 2021 г. и 15 август 2022 г. Те са разпределени на случаен принцип в групи, приемащи пегозафермин (подкожна инжекция, 15 mg или 30 mg веднъж седмично, или 44 mg веднъж на всеки 2 седмици) или плацебо (веднъж седмично или веднъж на всеки 2 седмици). Първичните крайни точки включват подобрение в ≥ стадий 1 на фиброзата и липса на прогресия на NASH. NASH е отшумял без фиброзна прогресия. В проучването е проведена и оценка на безопасността.
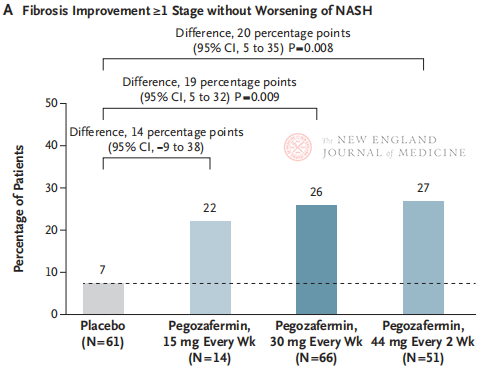
След 24 седмици лечение, делът на пациентите с ≥ стадий 1 подобрение на фиброзата и без влошаване на NASH, както и делът на пациентите с регресия на NASH и без влошаване на фиброзата са значително по-високи в трите дозови групи на Pegozafermin, отколкото в групата на плацебо, с по-значими разлики при пациентите, лекувани с 44 mg веднъж на всеки две седмици или 30 mg веднъж седмично. По отношение на безопасността, pegozafermin е подобен на плацебо. Най-честите нежелани реакции, свързани с лечението с pegozafermin, са гадене, диария и еритем на мястото на инжектиране. В това проучване фаза 2b, предварителните резултати показват, че лечението с pegozafermin подобрява чернодробната фиброза.
Пегозафермин, използван в това проучване, е дългодействащ гликолиран аналог на човешкия фибробластен растежен фактор 21 (FGF21). FGF21 е ендогенен метаболитен хормон, секретиран от черния дроб, който играе роля в регулирането на липидния и глюкозния метаболизъм. Предишни проучвания показват, че FGF21 има терапевтични ефекти върху пациенти с NASH чрез повишаване на инсулиновата чувствителност на черния дроб, стимулиране на окислението на мастни киселини и инхибиране на липогенезата. Краткият полуживот на естествения FGF21 (около 2 часа) обаче ограничава употребата му в клиничното лечение на NASH. Пегозафермин използва технология на гликозилирано пегилиране, за да удължи полуживота на естествения FGF21 и да оптимизира биологичната му активност.
В допълнение към положителните резултати в това клинично изпитване Фаза 2b, друго скорошно проучване, публикувано в Nature Medicine (ENTRIGUE), показа, че пегозафермин също значително намалява триглицеридите, не-HDL холестерола, аполипопротеин B и чернодробната стеатоза при пациенти с тежка хипертриглицеридемия, което може да има положителен ефект върху намаляването на риска от сърдечно-съдови събития при пациенти с NASH.
Тези проучвания показват, че пегозафермин, като ендогенен метаболитен хормон, може да осигури множество метаболитни ползи за пациенти с НАСХ, особено след като НАСХ може да бъде преименуван на метаболитно свързано мастно чернодробно заболяване в бъдеще. Тези резултати го правят много важно потенциално лекарство за лечение на НАСХ. В същото време, тези положителни резултати от проучването ще подкрепят включването на пегозафермин във фаза 3 на клинични изпитвания.
Въпреки че както двуседмичното лечение с пегозафермин от 44 mg, така и седмичното лечение с 30 mg е постигнало хистологичния първичен краен резултат на проучването, продължителността на лечението в това проучване е била само 24 седмици, а степента на съответствие в плацебо групата е била само 7%, което е значително по-ниско от резултатите от предишни клинични проучвания с продължителност 48 седмици. Разликите и сигурността еднакви ли са? Предвид хетерогенността на NASH, в бъдеще са необходими по-големи, многоцентрови, международни клинични проучвания, които да включат по-големи популации пациенти и да удължат продължителността на лечението, за да се оцени по-добре ефикасността и безопасността на лекарството.
Време на публикуване: 16 септември 2023 г.