Нозокомиалната пневмония е най-честата и сериозна нозокомиална инфекция, от която вентилатор-асоциираната пневмония (ВАП) представлява 40%. ВАП, причинена от резистентни патогени, все още е труден клиничен проблем. В продължение на години насоките препоръчват редица интервенции (като целенасочена седация, повдигане на главата) за предотвратяване на ВАП, но ВАП се среща при до 40% от пациентите с трахеална интубация, което води до по-дълъг болничен престой, повишена употреба на антибиотици и смърт. Хората винаги търсят по-ефективни превантивни мерки.
Вентилаторно-асоциираната пневмония (ВАП) е нововъзникваща пневмония, която се развива 48 часа след трахеална интубация и е най-честата и смъртоносна нозокомиална инфекция в интензивното отделение (ОИЛ). Насоките на Американското дружество по инфекциозни болести от 2016 г. разграничават ВАП от определението за болнично-придобита пневмония (БП) (БП се отнася само до пневмония, която възниква след хоспитализация без трахеална тръба и не е свързана с механична вентилация; ВАП е пневмония след трахеална интубация и механична вентилация), а Европейското дружество и Китай смятат, че ВАП все още е специален вид БП [1-3].
При пациенти на механична вентилация, честотата на вентилационна терапия (VAP) варира от 9% до 27%, смъртността се оценява на 13% и може да доведе до повишена системна употреба на антибиотици, продължителна механична вентилация, продължителен престой в интензивно отделение и повишени разходи [4-6]. HAP/VAP при пациенти без имунодефицит обикновено се причинява от бактериална инфекция, а разпределението на често срещаните патогени и техните характеристики на резистентност варират в зависимост от региона, болничния клас, популацията на пациентите и експозицията на антибиотици и се променят с течение на времето. Pseudomonas aeruginosa доминира сред патогените, свързани с VAP, в Европа и Америка, докато повече Acinetobacter baumannii са изолирани в третичните болници в Китай. От една трета до половината от всички смъртни случаи, свързани с VAP, са пряко причинени от инфекцията, като смъртността при случаите, причинени от Pseudomonas aeruginosa и acinetobacter, е по-висока [7,8].
Поради силната хетерогенност на вентилационно-аурикуларната терапия (VAP), диагностичната специфичност на клиничните ѝ прояви, образните и лабораторните изследвания е ниска, а диапазонът на диференциалната диагноза е широк, което затруднява навременното диагностициране на VAP. Същевременно бактериалната резистентност представлява сериозно предизвикателство за лечението на VAP. Смята се, че рискът от развитие на VAP е 3%/ден през първите 5 дни от използването на механична вентилация, 2%/ден между 5 и 10 дни и 1%/ден през останалото време. Пиковата честота обикновено настъпва след 7 дни вентилация, така че има прозорец, в който инфекцията може да бъде предотвратена рано [9,10]. Много проучвания са разглеждали превенцията на VAP, но въпреки десетилетията изследвания и опити за предотвратяване на VAP (като избягване на интубация, предотвратяване на повторна интубация, намаляване на седацията, повдигане на главата на леглото с 30° до 45° и грижа за устната кухина), честотата изглежда не е намаляла и свързаната с нея медицинска тежест остава много висока.
Инхалаторните антибиотици се използват за лечение на хронични инфекции на дихателните пътища от 40-те години на миналия век. Тъй като могат да увеличат максимално доставянето на лекарства до целевото място на инфекцията (т.е. дихателните пътища) и да намалят системните странични ефекти, те са показали добра приложна стойност при различни заболявания. Инхалаторните антибиотици вече са одобрени от Американската агенция по храните и лекарствата (FDA) и Европейската агенция по лекарствата (EMA) за употреба при кистозна фиброза. Инхалаторните антибиотици могат значително да намалят бактериалното натоварване и честотата на обострянията при бронхиектазии, без да увеличават общите нежелани събития, а настоящите насоки ги признават като лечение от първа линия при пациенти с инфекция с Pseudomonas aeruginosa и чести обостряния; Инхалаторните антибиотици по време на периоперативния период на белодробна трансплантация могат да се използват и като адювантни или профилактични лекарства [11,12]. Но в насоките на САЩ за VAP от 2016 г. експертите не са били уверени в ефективността на адювантните инхалаторни антибиотици поради липсата на големи рандомизирани контролирани проучвания. Публикуваното през 2020 г. проучване фаза 3 (INHALE) също не успя да постигне положителни резултати (инхалиране на амикацин, асистирани интравенозни антибиотици, при Грам-отрицателна бактериална инфекция, причинена от пациенти с вентилаторно-аурикуларизирана терапия (VAP), двойносляпо, рандомизирано, плацебо-контролирано проучване фаза 3 за ефикасност, общо 807 пациенти, системно лечение + асистирана инхалация на амикацин в продължение на 10 дни).
В този контекст, екип, ръководен от изследователи от Регионалния университетски болничен център в Тур (CHRU) във Франция, възприе различна изследователска стратегия и проведе инициирано от изследователя, многоцентрово, двойносляпо, рандомизирано контролирано проучване за ефикасност (AMIKINHAL). Инхалаторният амикацин или плацебо за превенция на вентилаторно-аурикуларната инжекция (VAP) бяха сравнени в 19 отделения за интензивно лечение във Франция [13].
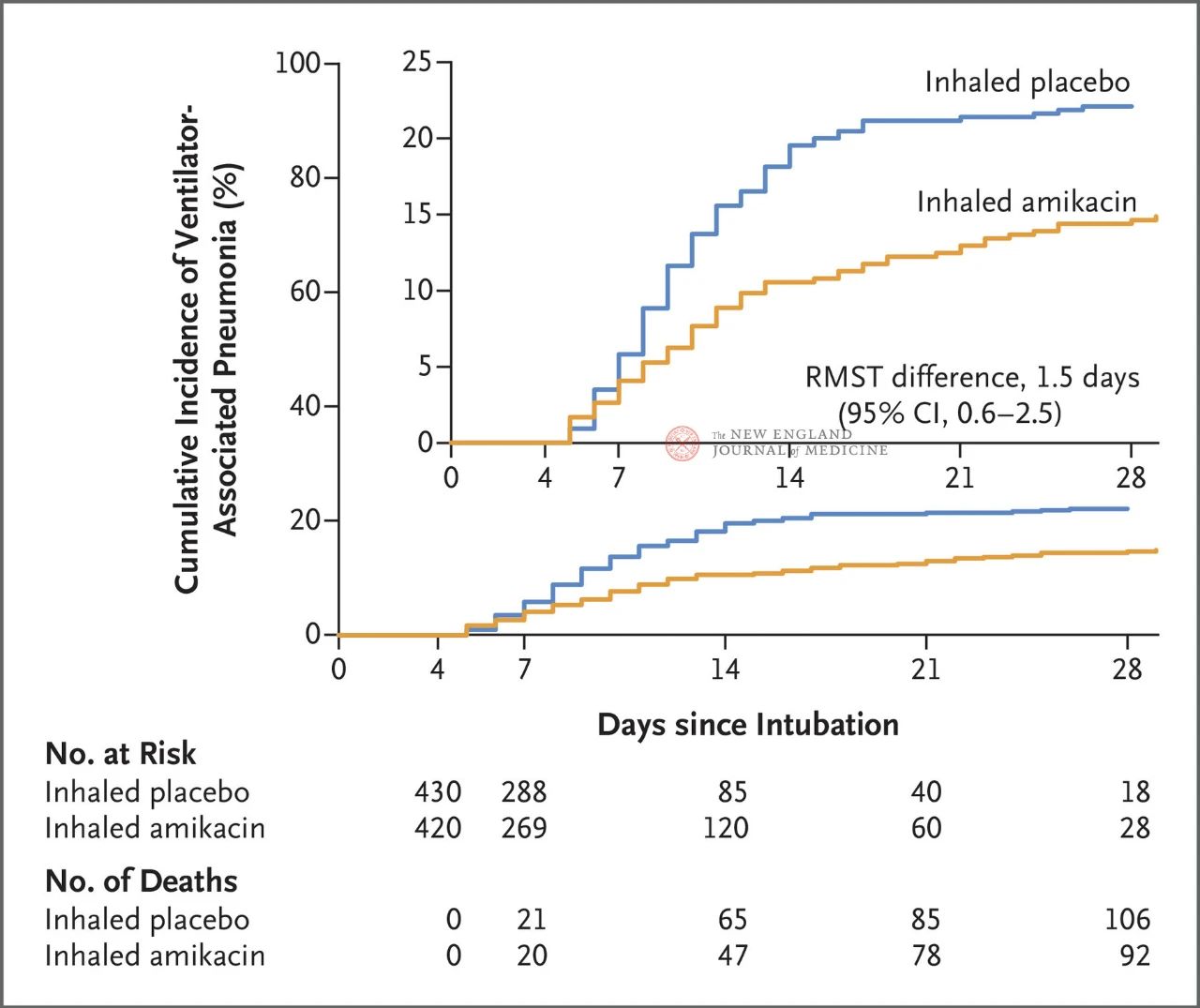
Общо 847 възрастни пациенти с инвазивна механична вентилация между 72 и 96 часа бяха разпределени на случаен принцип 1:1 за инхалиране на амикацин (N= 417,20 mg/kg идеално телесно тегло, QD) или инхалиране на плацебо (N=430, 0,9% еквивалент на натриев хлорид) в продължение на 3 дни. Първичната крайна точка беше първият епизод на вентилация с вентилатор (VAP) от началото на рандомизираното разпределение до 28-ия ден.
Резултатите от проучването показват, че на 28-ия ден 62 пациенти (15%) в групата на амикацин са развили вентилаторно-аурикуларна ангиография (VAP), а 95 пациенти (22%) в групата на плацебо са развили VAP (ограничената средна разлика в преживяемостта за VAP е 1,5 дни; 95% CI, 0,6~2,5; P=0,004).
По отношение на безопасността, седем пациенти (1,7%) в групата на амикацин и четирима пациенти (0,9%) в групата на плацебо са имали сериозни нежелани реакции, свързани с проучването. Сред тези, които не са имали остро бъбречно увреждане при рандомизацията, 11 пациенти (4%) в групата на амикацин и 24 пациенти (8%) в групата на плацебо са имали остро бъбречно увреждане на 28-ия ден (HR, 0,47; 95% CI, 0,23~0,96).
Клиничното изпитване имаше три акцента. Първо, по отношение на дизайна на изследването, изпитването AMIKINHAL се основава на изпитването IASIS (рандомизирано, двойносляпо, плацебо-контролирано, паралелно проучване фаза 2, включващо 143 пациенти). За да се оцени безопасността и ефективността на инхалационното системно лечение на грам-отрицателна бактериална инфекция, причинена от вентилаторна апнея (VAP), са извлечени поуки от изпитването INHALE, което завършва с отрицателни резултати и се фокусира върху превенцията на VAP, като са получени относително добри резултати. Поради характеристиките на високата смъртност и дългия болничен престой при пациенти на механична вентилация и VAP, ако инхалацията на амикацин може да постигне значително различни резултати при намаляване на смъртността и болничния престой при тези пациенти, това ще бъде по-ценно за клиничната практика. Въпреки това, предвид хетерогенността на късното лечение и грижи при всеки пациент и всеки център, има редица объркващи фактори, които могат да повлияят на изследването, така че може да е трудно да се получи положителен резултат, дължащ се на инхалаторни антибиотици. Следователно, успешното клинично проучване изисква не само отличен дизайн на изследването, но и избор на подходящи първични крайни точки.
Второ, въпреки че аминогликозидните антибиотици не се препоръчват като самостоятелно лекарство в различните насоки за вентилаторна апнея (VAP), аминогликозидните антибиотици могат да покрият често срещани патогени при пациенти с VAP (включително Pseudomonas aeruginosa, Acinetobacter и др.), и поради ограничената им абсорбция в белодробните епителни клетки, високата им концентрация на мястото на инфекцията и ниската системна токсичност. Аминогликозидните антибиотици са широко предпочитани сред инхалаторните антибиотици. Тази статия е в съответствие с подробната оценка на размера на ефекта от интратрахеалното приложение на гентамицин в малки проби, публикувана по-рано, което съвместно демонстрира ефекта на инхалаторните аминогликозидни антибиотици за предотвратяване на VAP. Трябва също да се отбележи, че повечето от плацебо контролите, избрани в проучванията, свързани с инхалаторни антибиотици, са физиологичен разтвор. Като се има предвид обаче, че атомизираното вдишване на физиологичен разтвор може да играе определена роля в разреждането на храчките и да помогне за отхрачващото му действие, физиологичният разтвор може да причини известни смущения в анализа на резултатите от проучването, което трябва да бъде всеобхватно взето предвид в проучването.
Освен това, локалната адаптация на HAP/VAP медикаментите е важна, както и антибиотичната профилактика. В същото време, независимо от продължителността на времето за интубация, екологията на местното интензивно отделение е най-важният рисков фактор за инфекция с мултирезистентни бактерии. Следователно, емпиричното лечение трябва да се основава максимално на микробиологичните данни на местните болници и не може сляпо да се позовава на насоките или опита на третичните болници. В същото време, критично болните пациенти, нуждаещи се от механична вентилация, често са комбинирани с мултисистемни заболявания и под комбинираното действие на множество фактори, като например стресово състояние, може да има и феномен на кръстосано взаимодействие на чревни микроби с белите дробове. Високата хетерогенност на заболяванията, причинена от вътрешна и външна суперпозиция, също определя, че мащабното клинично популяризиране на всяка нова интервенция е дълъг път.
Време на публикуване: 02 декември 2023 г.